Myoglobin Was ist, Eigenschaften und Betrieb dieses Proteins
- 4567
- 128
- Mattis Ney
Die Welt der menschlichen Biochemie erklärt in all ihren Bedeutungen die Stoffwechselprozesse, die in uns auftreten. Über ätherische Konzepte und eigene Identitäten hinaus müssen wir erkennen, dass das Mensch nichts weiter als eine Reihe von chemischen Wegen, elektrischen Impulsen, zellulären Atemzügen und Polypeptidketten ist, zumindest auf nur auf einer lediglichen physiologischen Ebene.
Daher, Tausende kleine Moleküle erklären unsere Verhaltensweisen, Gewohnheiten und Beschwerden. Magenenzyme sind für die Verdauung von Magen verantwortlich. Einfach: Wir sind die Biomoleküle, die wir synthetisieren, für kleine oder Nimien, die sie scheinen.
Unter all dem biologischen Konglomerat, das der menschliche Körper ist, gibt es eine Reihe von Proteinen oder Konjugaten, die für sehr spezifische Funktionen verantwortlich sind, die normalerweise der allgemeinen Versorgung der spezifischen Sprache entkommen, die mit. Hier werden wir sehen, was ist Myoglobin, ein Muskelheteroprotein, das viele Ähnlichkeiten mit klassischem Hämoglobin hat.
- Verwandter Artikel: "Kreislaufsystem: Was ist Teile und Eigenschaften"
Was ist Myoglobin?
Myoglobin ist ein Heteroprotein, dh es besteht aus einem Proteinteil (Apoprotein, Aminosäuren, der durch Peptidbindungen vereint ist) und ein weiteres Nicht -Protein mit kleinerer Größe, Die Prothesengruppe. Das wichtige Differentialmerkmal zwischen einem zu verwendenden Protein (Holoprotein) und einem Heteroprotein besteht darin.
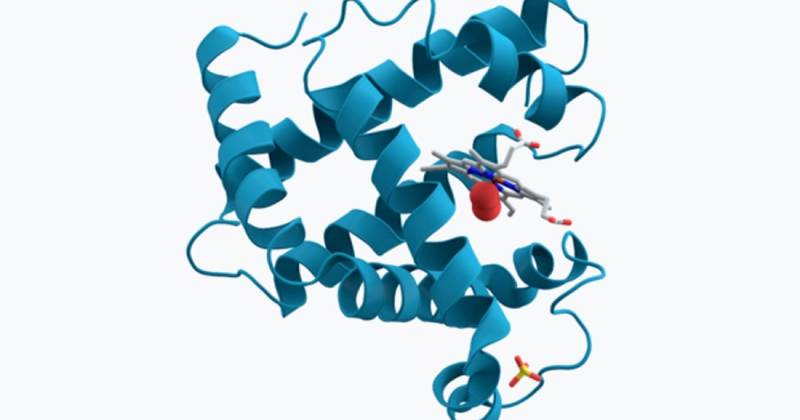
Wenn Sie mehr Thread stimmen, können wir betonen, dass Myoglobin ist ein chromoprotisches Heteroprotein, da es ein Metall in seiner chemischen Zusammensetzung aufweist, das gibt ihm eine charakteristische Färbung. Myoglobin besteht aus einem Polypeptidabschnitt von 153 Aminosäuren und einer Hämogruppe, die ein Eisenatom enthält, genau wie Hämoglobin. Aufgrund dieser „HEMO“ -Gruppe können wir bestätigen, dass die Hauptfunktion von Myoglobin darin besteht, Sauerstoff zu speichern.
Außerdem sollte angemerkt werden, dass Myoglobin Es besteht aus einer einzelnen Polypeptidkette, die von 8 Alpha -Propellern (Sekundärstruktur der Aminosäurekonformation) gebildet wird, die mit einem Sauerstoffinsertionspunkt assoziiert ist. In der Mitte präsentiert es einen Porphyrinring, der Eisen enthält. Eine proximale Histidingruppe (HIS-93) ist direkt mit dem Eisenmolekül verbunden, während eine distale Histidingruppe (HIS-64) auf die entgegengesetzte Gesichtsfläche der Formation gelegt wird.
Im Gegensatz dazu besteht Hämoglobin (verantwortlich für den Transport von Sauerstoff in Blut in roten Blutkörperchen) aus vier verschiedenen Polypeptiden und vier Sauerstoffbindungspunkten, die verschiedene kinetische Bindungseigenschaften ermöglichen. Das könntest du sagen, Aus chemischer Sicht ist dies "komplexer" als Myoglobin.
Wenn wir möchten, dass Sie mit einer Vorstellung von all diesem Konglomerat bleiben, ist dies wie folgt: Myoglobin wird nur durch eine Aminosäurkette (Polypeptid) gebildet, die wiederum in Form von 8 Alpha -angeschlossenen Hallen auftritt, die in einem angeordnet sind gerollter Weg dreidimensionale Konformation. Im Zentrum von Heteroprotein befindet sich eine Hämogruppe mit Eisenmolekül. Wenn wir seine tertiäre Struktur entspannen könnten, würden wir eine Schnur von 8 Untereinheiten sehen, die an einem Hämo -Ring befestigt sind.
- Sie können interessiert sein: "Erythrozyten (rote Blutkörperchen): Eigenschaften und Betrieb"
Myoglobinfunktion
Wie Hämoglobin, Myoglobin Es ist ein zytoplasmatisches Heteroprotein, das die Vereinigung von Sauerstoff zu einer Hämogruppe ermöglicht. Wie auch immer, Hämoglobin mit vier Polypeptidketten (Globin) verfügt. Daher hat Hämoglobin mehr "Sauerstoffbelastung", während Myoglobin eine größere Affinität zu ihm hat, aber in weniger Menge (nur ein Hemo/ein O2 -Molekül). Diese Unterschiede sind in Verbindung mit der Funktionalität jedes Moleküls: Hämoglobintransporte, während Myoglobin speichert.
An diesem Punkt sollte beachtet werden, dass das Myoglobinkonzentrationen sind in der gestreiften Muskulatur von Wirbeltieren maximal, Insbesondere im Zytoplasma der Kardiomyozyten und im Sarkoplasma der Muskelfasern. Basierend auf dieser Prämisse kann davon ausgegangen werden, dass die Hauptfunktion von Myoglobin darin besteht.
Mit anderen Worten, Myoglobin dient als Puffer der intrazellulären Sauerstoffkonzentration und auch als O2 -Reserve auf Muskelebene. Dieses Konzept wird durch eine Realität so neugierig wie erwartet bestätigt: Tiere, die im Wasser leben und große Zeiträume mit untergetauchten Zeit verbringen.

Diese sind Einige weitere Funktionen von Myoglobin, die in der Organismusumgebung kontextualisiert wurden:
- Es erleichtert die Diffusion von Sauerstoff: Dieses Heteroprotein wird zu Beginn der Muskelaktivität abgeleitet, wodurch der Sauerstoffdiffusionsgradient von Kapillaren zum Zytoplasma erhöht wird.
- Es scheint enzymatische Funktionen zu haben: Es ist erforderlich, damit aktive Stickoxid zum Nitrat ist. Stickoxidstoffwechsel begünstigt die mitochondriale Aktivität.
- Es hilft dabei. Daher hilft Myoglobin, seine Konzentrationen minimal zu sein.
Wie du sehen kannst, Die Funktionalität von Myoglobin liegt nicht nur in der Lagerung eines O2 -Moleküls dank seiner Hämogruppe. Obwohl dies Ihre Hauptarbeit ist, präsentiert es auch andere, genauso wichtig für das Brunnen in der Zellumgebung.
Die Rolle von Myoglobin in klinischen Gemälden
Myoglobin wird vom MB -Gen beim Menschen codiert, und als jede ordentliche Sequenz von DNA ist dies anfällig für Mutationen. Die Dysfunktionalität des MB -Gens wurde mit verschiedenen Erkrankungen wie dem Kompartiment -Syndrom oder dem Medulloblastom in Verbindung gebracht.
Darüber hinaus entwickeln experimentelle Modelle (Knockout -Mäuse) mit mutiertem Myoglobin während der fetalen Entwicklung tödliche Erkrankungen auf Herzebene. Die wenigen Modelle, die diese Bedingungen überleben. Daher wird angegeben, dass Myoglobin Es ist wichtig für die Körperfunktion.
Über ein mutmaßliches Gelände hinaus wurde es direkt mit Myoglobin mit einer weithin bekannten klinischen Einheit in Verbindung gebracht: Rabbomiolyse. In diesem schweren Zustand wird in der Myozytenmembran (Muskelzelle) Schädigung der Myozytenmembran (Muskelzelle), die bei der Akkumulation von abnormalem Kalzium im Muskel stammt (in der Myozytenmembran (. Dies setzt Lyse und muskuläre Nekrose an, was wiederum die Blutkonzentration von Molekülen erhöht.
Interessanterweise Myoglobin Es ist das Protein, das in den Nieren mehr Schäden erzeugt, wenn es das Kreislaufsystem infiltriert und in der Nierenumgebung "gefiltert" wird. Es wird angenommen, dass dieses Heteroprotein in den Nieren -Tubuli ausfällt, sich ansammelt und Obstruktionen verursacht. Dieser Toxizitätsmechanismus erklärt teilweise, warum das Nierenversagen eine der Haupt Nebenwirkungen der Rhabdomyolyse ist.
Schließlich sollte beachtet werden, dass das Vorhandensein von Myoglobin im Urin gemessen wird, um diesen Zustand zu erkennen, da eine Konzentration von 100 mg/dl die Farbe der PIs ändern kann.
Zusammenfassung
Wenn wir auf ein Protein, ein Enzym oder ein Molekül im Zusammenhang mit dem Stoffwechsel achten, ist es ein schwerwiegender Fehler, mit seiner Hauptstruktur und -funktion allein zu bleiben. Ja, Myoglobin speichert Sauerstoff, um Muskelhypoxie zu vermeiden, hat aber auch enzymatische Aktivität, neutralisiert reaktive Sauerstoffspezies, erleichtert die Diffusion von O2 in der Zellumgebung und dient als eines der diagnostischen Kriterien für die Rhabdomyolyse (entweder in der Konzentrationsplasma oder in seinem Konzentrationsplasma oder im Urin)).
Schließlich hat jede Biomolekül mehr als eine Funktion in unserem Körper, und wenn wir glauben, dass es nur einen Job erfüllt, wird es sicherlich daran liegen, dass wir den Rest nicht entdeckt haben.

