Immunglobuline Was sind, Typen, Eigenschaften und Funktionen
- 1685
- 156
- Milo Hentschke
Laut der globalen Studie der Krankheitslast haben 95% der Weltbevölkerung ein gewisses Gesundheitsproblem, zumindest in der Stichprobengruppe, die zwischen 1990 und 2013 analysiert wurde. Es ist nicht überraschend, da 15% der globalen Biomasse in Form von Kohlenstoff aus Bakterien (70 Gigatons) bestehen, von denen einige für den Menschen, andere Gäste und andere direkt pathogen sind.
Über Bakterien hinaus gibt es Tausende nicht-viologischer Infektionsmittel in Form von Viren, die sich hektisch mutieren und sich entwickeln, um die Immunität von Langzeitorganismen zu überwinden. Der Wettbewerb des Menschen mit Krankheitserregern ist eine authentische Waffenkarriere: Wenn vor einem Erreger eine spezifische Reaktion entwickelt wird, wird erwartet, dass sie mutiert, um von Lymphozyten und anderen spezifischen Körpern nicht mehr erkannt zu werden.
Aus diesem Grund sind Grippeimpfungen jährlich, während andere Impfstoffe einem bestimmten Erreger eine Lebensimmunität gewähren. Abhängig von der Mutation und Anpassungsrate des Mikroorganismus können die Infektionswahrscheinlichkeiten im Laufe der Zeit steigen oder verringern. Basierend auf diesen interessanten Räumlichkeiten erzählen wir Ihnen alles, was Sie wissen sollten Immunglobuline.
- Verwandter Artikel: "Immunsystem: Was ist, Teile, Funktionen und Eigenschaften"
Was sind Immunglobuline?
Nach Angaben des National Cancer Institute (NIH) ist ein Immunglobulin oder ein Antikörper Ein Protein, das von Plasmazellen (Arten von weißen Blutkörperchen) als Reaktion auf das Vorhandensein eines Antigens veröffentlicht wurde, Eine Substanz, die dazu führt, dass der Mensch des Menschen aktiviert wird, sich als Bedrohung erkennen. Der Schlüssel zum Verständnis der Immunität basiert auf dem Antikörper (IG) (AG) -Dyade oder dem gleichen IG -Ag, Ig -Ag.
Jedes Immunglobulin bindet an ein einzelnes Antigen, so Einige von ihnen können das Antigen auch direkt zerstören. Jeder Antikörper verfügt. Mit anderen Worten, jeder Ig-Ag-Komplex ist ein kompromissloser Schlüssel und Sperre.
Der klarste Nutzen von Immunglobulinen in der allgemeinen Gesellschaft ist ohne Zweifel die Entwicklung von Impfstoffen. Wenn im Organismus ein geschwächtes Virus oder Bakterien eingeführt wird (oder ein Abschnitt davon, der eine Immunantwort fördert), wird die Proliferation von Lymphozyten und die Freisetzung spezifischer Immunglobuline für das Antigen stimuliert. So, Der Körper "lernt", was ist der gefährliche Mikroorganismus, immer aus der Sicherheit einer früheren pathogenen Inaktivierung.
Dank dieses sicheren Immunisierungsmechanismus wird geschätzt, dass in den letzten 20 Jahren mehr als 37 Millionen Menschenleben auf der ganzen Welt gerettet wurden, insbesondere bei Kindern, insbesondere bei Kindern. Ein klares Beispiel dafür ist Pocken: Im 18. Jahrhundert 400.Jährlich starben 000 Menschen für diese Krankheit, die in die Letalität des Wirkstoffs von fast 30% verwandelt wurde. Dank der Impfung wurde 1977 der letzte Fall von Pocken diagnostiziert, und der in den achtziger Jahren die erpathogenfreie Welt erklärte. Zweifellos hat das Wissen über Immunglobuline es uns ermöglicht, epidemiologische Verwüstungen loszuwerden.
Struktur dieser Proteine
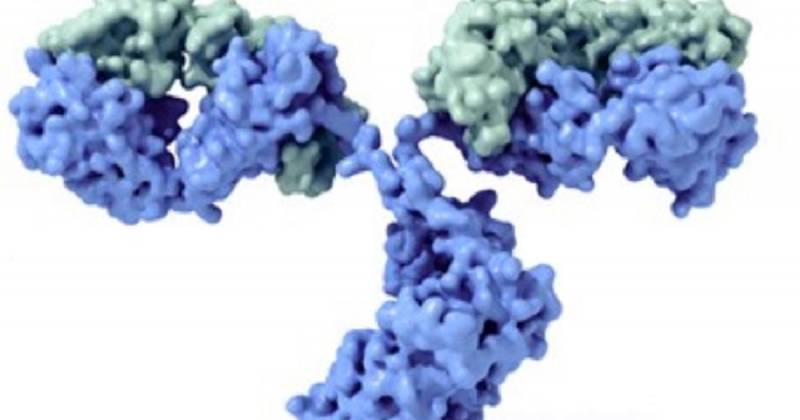
Immunglobuline haben eine typische Form von "y", die aus zwei verschiedenen Hälften besteht. Sie müssen sich diese Konformation klar vorstellen, bevor Sie fortfahren, da wir uns auf dieses Muster verlassen werden, um die allgemeine Bildung von Antikörpern zu beschreiben.

Wie jedes Protein, Ein Immunglobulin hat als basale Einheit die Aminosäure, jede der Untereinheiten, die zusammen durch Peptidbindungen zu Peptiden führen (weniger als 10 Aminosäuren), Polypeptide (mehr als 10) und Proteine (viele verkettete Aminosäuren). In diesem Fall besteht Typ -Immunoglobulin aus 4 Polypeptideinheiten: zwei gleiche schwere Ketten zwischen ihnen (schwer, an der Basi die Auswirkungen des "y").
Jede „H“ -Werregion besteht aus einer variablen Region (VH) und 3-4 konstante Regionen (CH1, CH2, CH3 usw.). Andererseits bestehen die Lichtketten "L" aus einem variablen Bereich (VL) und einer anderen Konstante (CL). All dies mag sehr gerade klingen, aber es ist nur notwendiger Kerl.
Die Form in "Y" ist das typische, das in Biologie- und Immunologieklassen ausgesetzt ist, aber nicht die einzige. Diese monomere Form umfasst Immunglobuline D, E und G, während Ig A ein Dimer ist und der IG M ein Pentamer ist. Wie du dir vorstellen kannst, Diese anatomischen Veränderungen beinhalten auch eine klare Variabilität der Funktionalität.
- Sie können interessiert sein: "Die 4 Arten von Krankheitserregern (und deren Eigenschaften)"
Die Arten von Immunglobulinen
Wir verlassen den molekularen Wald, um zu etwas allgemeineren Themen zurückzukehren, diesmal die unterschiedlichen Funktionen von Immunglobulinen gemäß ihrer Bezeichnung. Wir beschreiben sie kurz.
1. Immunglobulin a
Es kommt in den Schleimbeschichtungen des Atemwegs, im Urogenitaltrakt und im Licht des Verdauungssystems sowie Speichel, Tränen und Muttermilch vor. Interessanterweise ist es im Blut in monomerer Form (wie die "und" beschrieben), aber in den Schleimhäuten ist seine Disposition dimisch.
Aufgrund seiner Nähe zu den einzigen offenen Systemen innerhalb des menschlichen Körper Sie sind die ersten, die mit Viren in Kontakt kommen, die in die Oropharyngealhöhle und andere Darmmikroorganismen eindringen.
2. Immunglobulin g
Dieses Immunglobulin ist derjenige, der am meisten im Blut, der Cerebrospinalflüssigkeit und der Peritonealflüssigkeit (der Bauchhöhle) dargestellt wird (der Bauchhöhle). Es macht 80% der gesamten Immunglobuline aus, Also ohne Zweifel ist es das vorherrschende.
Darüber hinaus ist zu beachten, dass es 4 Subvarianten dieser Art von Immunglobulin gibt, von IgG 1 bis zum IgG4. Jeder von ihnen ist besonders in einer bestimmten Front geschickt und erkennt Antigene und Toxine verschiedener Mikroorganismen.
3. Immunglobulin m
Es wird auf der Oberfläche von B -Lymphozyten ausgedrückt, den Haupteffektoren der humoralen Reaktion des adaptiven Immunsystems.
Sie sind der Kontingenzgang auf eine Infektion, da sie die Krankheitserreger in frühen Stadien beseitigen Bis das Immunsystem genügend IgG-Typ synthetisiert. Sie nehmen 6% der zirkulierenden Immunglobuline im menschlichen Blutkreislauf an und sind in der überwiegenden Mehrheit der Tiere vorhanden, daher werden die ältesten Antikörper in der Evolutionsgeschichte als Wirbeltiere betrachtet.
4. Immunglobulin e
Der Antikörper, der mit dem klinischen Niveau mit den allergischen Bildern zusammenhängt. Normalerweise dieses Immunglobulin Es kommt in kleinen Mengen vor, die im Blut zirkuliert, aber zunehmend drastisch, wenn der Körper einem Allergen ausgesetzt ist, oder was ist gleich, eine harmlose Substanz, die eine ungerechtfertigte Reaktion im Immunsystem des Individuums verursacht. Es wird auch in atypischen Mengen gegen parasitäre Infektionen ausgedrückt.
5. Immunglobulin d
Dies ist einer der Immunglobuline, die weniger ausgedrückt werden, aber nicht weniger wichtig ist. Repräsentiert nur 1% der gesamten Immunglobuline des Körpers und Es ist die größte Komponente der Oberfläche vieler Typ -B -Lymphozyten in seiner Reifungsphase. Aufgrund seines Mangels ist seine Funktion weniger definiert als die der restlichen Varianten, die bereits beschrieben wurden.
Zusammenfassung
Wie Sie sehen konnten, gibt es Immunglobuline in verschiedenen Formen (Isotypen) und morphologischen Dispositionen, aber alle haben eine sehr klare Funktion: Schützen Sie den Organismus vor möglichen Infektionen und Krankheitserregern. Vom Virus bis hin zu morphologisch komplexeren Parasiten (wie Helminthen) können Immunglobuline sie erkennen, den Rest der Immunzellen aktivieren, sie basierend auf ihren Oberflächenantigenen markieren und nach der relevanten Kaskadenreaktion beseitigen.
Zusammenfassend lässt sich sagen. Von Immunantworten bis hin zu allergischen Reaktionen haben Antikörper verschiedene Schutzfunktionen.
- « Die neurologischen Grundlagen der Lesemerkmale und Entdeckungen
- Familie Ecomopa Was ist, Eigenschaften und wie es geht »

