Disulfursäureeigenschaften und Funktionen dieser Substanz
- 3901
- 954
- Julia Becker
Wir haben alle von Schwefelsäure gehört, auch wenn sie vorbei ist. Diese extrem ätzende und gefährliche Substanz ist die am besten produzierte chemische Verbindung weltweit. Es ist besonders wichtig in der Ölindustrie, der Behandlung von Stahl, der Herstellung von Sprengstoff, Reinigungsmitteln und Kunststoffen sowie in der Synthese von Düngemitteln.
Ohne Schwefelsäure wäre es nicht möglich, die Holz- und Papierindustrie, viele Textilfabrikprozesse oder die Batterieproduktion zu steigern. Ihre Rolle in der chemischen Industrie kann auch nicht vergessen werden, da sie für die Synthese anderer lebenswichtiger Säuren und Sulfate für bestimmte Prozesse erforderlich ist.
Mit anderen Worten, die Gesellschaft wäre nicht so, wie wir sie ohne Schwefelsäure kennen, da sie unter anderem wesentliche Aufgaben in der chemischen Industrie, in der Ölgesellschaft und im landwirtschaftlichen Bereich spielt, unter anderem. Wie auch immer, nicht alle Schwefelverbindungen sind gleichermaßen bekannt. Hier achten wir auf eine weniger vertraute für die allgemeine Bevölkerung: Disulfursäure.
- Verwandter Artikel: "Die 11 Arten chemischer Reaktionen"
Was ist Disulfursäure?
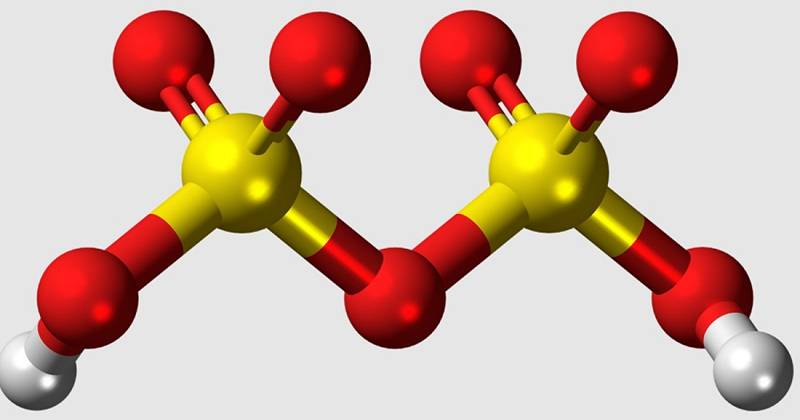
Disulfursäure, auch als Pyrosulfursäure oder Oleum bekannt, ist eine Oxazid aus Schwefel. Der Begriff "Oxácido" bezieht.
Disulfursäure ist die Hauptkomponente des Rauchens oder Ölschwefelsäure, deren Eigenschaften und Verwendung wir in zukünftigen Abschnitten erklären werden. Im Moment bleiben wir mit seiner Chemikalie H2SO7 zurück. Dies bedeutet, dass es durch zwei Wasserstoffatome (H2), 7 Sauerstoff (O7) und zwei Schwefel (S2) gebildet wird. Die zu verwendende Schwefelsäure hat inzwischen zwei Wasserstoffatome, einen von Schwefel und vier Sauerstoff (H2SO4).
Es ist auch von Interesse zu betonen, dass diese Säure eine Molmasse von 178 hat.13 g · mol - 1 und dass sein Schmelzpunkt 36 Grad beträgt, eine Temperatur, die die Änderung eines festen zu flüssigen Zustands markiert. Es gibt andere Säuren mit derselben Formel „H2O · (SO3) x“, obwohl diese heute nicht unter experimentellen Bedingungen isoliert werden können.
- Sie können interessiert sein: "Die 15 physikalischen und chemischen Eigenschaften von Wasser" "
Öleigenschaften
Wie wir gesagt haben, Disulfursäure Es ist die Hauptkomponente von Rauchschwefelsäure, auch als Oleum bekannt. Die Formel dieser Lösung lautet YSO3 · H2O, sendo „y“ die gesamte Molmasse des Schwefeltrioxids (SO3). Wie auch immer, es kann auch mit der Nomenklatur „H2SO4 · XSO3“ ausgewiesen werden. Wenn x = 1 e y = 2, wird die Formel H2S2O7 erhalten oder was ist der von Disulfursäure.
Es mag komplex klingen, aber bleiben Sie bei der folgenden Idee: Eine Oleum -Lösung kann unterschiedliche Eigenschaften entsprechend dem Prozentsatz der Schwefelsäurekonzentration aufweisen, und die oben genannte Konformation führt zu Disulfursäure, die solide bis zu 36 Grad der Temperaturumgebung auftritt. So interessant, dass all dieses Konglomerat in der Chemikalie sowieso notwendig ist, dies zu betonen Disulfursäure wird in Labor- oder Industrieprozessen selten eingesetzt.
Das Oleum wird durch einen „Kontaktprozess“ synthetisiert, bei dem Sauerstoffgruppen zu Schwefel (S+O3, SO3) zugesetzt und dann in einem Schwefelsäurekonzentrat gelöst werden (H2SO4). Vielleicht würde eine Chemikalie aus den Haaren geworfen werden, wenn sie eine so große Vereinfachung sehen, aber für informative Zwecke haben wir die Lizenz genommen, Ihnen die Vereinigung beider Konzepte zu zeigen:

Somit wird der typische Oleum oder die Disulfursäure mit Schwefel gebaut, zu dem Sauerstoff und Konzentrat von Schwefelsäure zugesetzt wurden. In der Welt der Chemie ist am Ende alles auch eine Frage des mathematischen Wissens.
Funktionen und Versorgungsunternehmen dieser Substanz
Sobald wir die chemische Natur dieser komplexen Lösung zerlegt haben, können wir ihre Verwendung auch kurz untersuchen.
1. Schwefelsäureproduktion
Obwohl es sich kontraintuitiv anhört, Eine Lösung, die Schwefelsäure für ihre Synthese benötigt, kann für die Produktion von Schwefelsäure selbst nützlich sein.
Aufgrund seiner hohen Hydratationenthalpie (Änderung der Enthalpie, wenn ein Mol von Ionen in ausreichend Wasser auflöst.
Im Gegenteil, wenn SO3 direkt zum Wasser zugegeben würde.
@Image (28510)
2. Transportvermittler
Da wird das Oleum in Festkörpern bis zu 36 Grad Temperatur dargestellt, Es kann für den Transport von Schwefelsäure in Lastwagen mit Tanks, zwischen Ölen und verschiedenen Branchen nützlich sein. Sobald es sein Ziel erreicht hat, kann das Oleum in seinem flüssigen Zustand erneut transformiert werden. Wie auch immer, dieser Prozess muss sehr vorsichtig durchgeführt werden, da eine Überhitzung des Materials (Überhitzung) die Sicherheitsgrenzen überschreitet.
Darüber hinaus ist die Oleum oder die Disulfursäure weniger korrosiv als Schwefelsäure zu verwenden, wenn sie mit Metallen in Kontakt kommen, da es keine freien Wassermoleküle gibt, die diese Oberflächen angreifen können. Daher werden manchmal auch flüssige Disulfursäure für den Transport zwischen komplexen Rohren ausgewählt. Aufgrund seiner Fähigkeit, in konzentrierter Schwefelsäure und seiner Leichtigkeit, sich von Festkörper zu Flüssigkeit zu wechseln.
3. Disulfursäure in der Sprengindustrie
Das Oleum auch Es wird in der Synthese von Sprengstoff verwendet, mit der bemerkenswerten Ausnahme von Nitrocellulose. Dies liegt daran.
4. Verwendung in der Untersuchung der organischen Chemie
Oleum ist ein aggressives und hochkarrosives Reaktivmittel, das als Vermittler bei bestimmten chemischen Reaktionen nützlich ist.
Zusammenfassung
Zusammenfassend kann die Disulfursäure als Vermittler von Schwefelsäure angesehen werden, obwohl sie aus Reaktionen stammen, die sie in erster Instanz erfordern. Wie in einem Festkörper auf natürliche Weise dargestellt, ist es für einen sicheren Transport in vielen Branchensektoren angegeben, die natürlich mit H2SO4 umgehen. Es ist auch sehr interessant, diese Verbindung in ihrer flüssigen Form zu verwenden, da sie weniger korrosiv als Schwefelsäure ist, erzeugt sie weniger Schäden an Rohren und anderen Metallbeschichtungen.
Wir nehmen wieder die Idee wieder auf, dass Schwefelsäure für landwirtschaftliche, Holz, Textil, Öl und viele andere Zweige der Branche wesentlich ist. Obwohl Disulfursäure als direkt anwendbare Verbindung im Laborbereich nicht sehr nützlich ist, gibt sie beim Transport, Verfeinerung und Behandlung der Schwefelsäure selbst eine bestimmte Plastizität an.
- « Die psychologischen Folgen von Verkehrsunfällen
- 7 Tricks, nicht hinter dem Lenkrad einzuschlafen »

